Химические элементы на Земле¶
Кларки химических элементов¶
Прежде чем рассматривать значение тех или иных химических элементов в биосфере, необходимо выяснить их содержание в геосферах Земли.
Содержание химических элементов в живом веществе рассмотрено ранее.
Химики и петрографы (изучение горных пород) начиная со второй половины XIX века изучали химический состав горных пород методами весового и объёмного химического анализа.
Суммируя результаты многочисленных анализов горных пород, Франк Уиглсуорт Кларк показал, что в земной коре преобладают восемь химических элементов: кислород, кремний, алюминий, железо, кальций, натрий, калий и магний. Этот основной вывод неоднократно был подтверждён результатами и последующих исследований.
Кларки элементов в земной коре (мг/кг, ppm)
| Элемент | Символ | Clarke & Washington, 1924 | Ферсман, 1933–1939 | Goldschmidt, 1937 | Виноградов, 1962 | Taylor, 1964 |
|---|---|---|---|---|---|---|
| Кислород | O | 495200 | 491300 | 466000 | 470000 | 464000 |
| Кремний | Si | 257500 | 260000 | 277200 | 295000 | 281500 |
| Алюминий | Al | 75100 | 74500 | 81300 | 80500 | 82300 |
| Железо | Fe | 47000 | 42000 | 50000 | 46500 | 56300 |
| Кальций | Ca | 33900 | 32500 | 36300 | 29600 | 41500 |
| Натрий | Na | 26400 | 24000 | 28300 | 25000 | 23600 |
| Калий | K | 24000 | 23500 | 25900 | 25000 | 20900 |
| Магний | Mg | 19400 | 23500 | 20900 | 18700 | 23300 |
| Водород | H | 8800 | 10000 | - | - | - |
| Титан | Ti | 5800 | 6100 | 4400 | 4500 | 5700 |
| Хлор | Cl | 1900 | 2000 | 480 | 170 | 130 |
| Фосфор | P | 1200 | 1200 | 1200 | 930 | 1050 |
| Углерод | C | 870 | 3500 | 320 | 230 | 200 |
| Марганец | Mn | 800 | 1000 | 1000 | 1000 | 950 |
| Сера | S | 480 | 1000 | 520 | 470 | 260 |
| Барий | Ba | 470 | 500 | 430 | 650 | 425 |
| Хром | Cr | 330 | 300 | 200 | 83 | 100 |
| Азот | N | 300 | 400 | - | 19 | 20 |
| Фтор | F | 270 | 800 | 800 | 660 | 625 |
| Цирконий | Zr | 230 | 250 | 220 | 170 | 165 |
| Никель | Ni | 180 | 200 | 100 | 58 | 75 |
| Стронций | Sr | 170 | 350 | 150 | 340 | 375 |
| Ванадий | V | 160 | 200 | 150 | 90 | 135 |
| Кобальт | Co | 100 | 20 | 40 | 18 | 25 |
| Медь | Cu | 100 | 100 | 70 | 47 | 55 |
| Уран | U | 80 | 4 | 4 | 2,5 | 2,7 |
| Вольфрам | W | 50 | 70 | 1 | 1,3 | 1,5 |
| Литий | Li | 40 | 50 | 65 | 32 | 20 |
| Цинк | Zn | 40 | 200 | 80 | 83 | 70 |
| Гафний | Hf | 30 | 4 | 4,5 | 1 | 3 |
| Свинец | Pb | 20 | 16 | 16 | 16 | 12,5 |
| Торий | Th | 20 | 10 | 11,5 | 13 | 9,6 |
| Бор | B | 10 | 50 | 10 | 12 | 10 |
| Бериллий | Be | 10 | 4 | 6 | 3,8 | 2,8 |
| Мышьяк | As | x | 5 | 5 | 1,7 | 1,8 |
| Бром | Br | x | 10 | 2,5 | 2,1 | 2,5 |
| Молибден | Mo | x | 10 | 2,3 | 1,1 | 1,5 |
| Рубидий | Rb | x | 80 | 280 | 150 | 90 |
| Олово | Sn | x | 80 | 40 | 2,5 | 2 |
| Кадмий | Cd | 0,x | 5 | 0,18 | 0,13 | 0,2 |
| Ртуть | Hg | 0,x | 0,05 | 0,5 | 0,083 | 0,08 |
| Иод | I | 0,x | 10 | 0,3 | 0,4 | 0,5 |
| Сурьма | Sb | 0,x | 0,5 | (1) | 0,5 | 0,2 |
| Скандий | Sc | 0,x | 6 | 5 | 10 | 22 |
| Серебро | Ag | 0,0x | 0,1 | 0,02 | 0,07 | 0,07 |
| Висмут | Bi | 0,0x | 0,1 | 0,2 | 0,009 | 0,17 |
| Селен | Se | 0,0x | 0,8 | 0,09 | 0,05 | 0,05 |
| Золото | Au | 0,00x | 0,005 | 0,001 | 0,0043 | 0,004 |
| Цезий | Cs | 0,00x | 10 | 3,2 | 3,7 | 3 |
| Платина | Pt | 0,00x | 0,2 | 0,005 | - | - |
| Теллур | Te | 0,00x | 0,01 | (0,0018?) | 0,001 | - |
| Иридий | Ir | x·10−4 | 0,01 | 0,001 | - | - |
| Осмий | Os | x·10−4 | 0,05 | - | - | - |
| Таллий | Tl | x·10−4 | 0,1 | 0,3 | 1 | 0,45 |
| Галлий | Ga | x·10−5 | 1 | 15 | 19 | 15 |
| Германий | Ge | x·10−5 | 4 | 7 | 1,4 | 1,5 |
| Индий | In | x·10−5 | 0,1 | 0,1 | 0,25 | 0,1 |
| Палладий | Pd | x·10−5 | 0,05 | 0,01 | 0,013 | - |
| Родий | Rh | x·10−5 | 0,01 | 0,001 | - | - |
| Рутений | Ru | x·10−5 | 0,05 | - | - | - |
| Радий | Ra | x·10−6 | 2·10−6 | - | - | - |
| Актиний | Ac | - | - | - | - | - |
| Аргон | Ar | - | 4 | - | - | - |
| Церий | Ce | - | 29 | 41,6 | 70 | 60 |
| Диспрозий | Dy | - | 7,5 | 4,47 | 5 | 3 |
| Эрбий | Er | - | 6,5 | 2,47 | 3,3 | 2,8 |
| Европий | Eu | - | 0,2 | 1,06 | 1,3 | 1,2 |
| Гадолиний | Gd | - | 7,5 | 6,36 | 8 | 5,4 |
| Гелий | He | - | 0,01 | - | - | - |
| Гольмий | Ho | - | 1 | 1,15 | 1,7 | 1,2 |
| Криптон | Kr | - | 2·10−4 | - | - | - |
| Лантан | La | - | 6,5 | 18,3 | 29 | 30 |
| Лютеций | Lu | - | 1,7 | 0,75 | 0,8 | 0,5 |
| Ниобий | Nb | - | 0,32 | 20 | 20 | 20 |
| Неодим | Nd | - | 17 | 23,9 | 37 | 28 |
| Неон | Ne | - | 0,005 | - | - | - |
| Протактиний | Pa | - | 7·10−7 | - | - | - |
| Полоний | Po | - | 0,05 | - | - | - |
| Празеодим | Pr | - | 4,5 | 5,53 | 9 | 8,2 |
| Рений | Re | - | 0,001 | 0,001 | 7·10−4 | - |
| Радон | Rn | - | ? | - | - | - |
| Самарий | Sm | - | 7 | 6,47 | 8 | 6 |
| Тантал | Ta | - | 0,24 | 2,1 | 2,5 | 2 |
| Тербий | Tb | - | 1 | 0,91 | 4,3 | 0,9 |
| Технеций | Tc | - | 0,001 | - | - | - |
| Тулий | Tm | - | 1 | 0,2 | 0,27 | 0,48 |
| Ксенон | Xe | - | 3·10−5 | - | - | - |
| Иттрий | Y | - | 50 | 28,1 | 29 | 33 |
| Иттербий | Yb | - | 8 | 2,66 | 0,33 | 3 |

Методами химического анализа, которыми пользовались в XIX веке, определение низких концентраций элементов было невозможно. Требовались принципиально иные подходы.
Мощный импульс изучению химических элементов с очень низкой концентрацией в веществе земной коры дало применение более чувствительного метода — спектроскопического анализа. Новые факты позволили В.И. Вернадскому сформулировать принцип «всюдности» химических элементов, который долгое время вызывал настороженность даже со стороны крупных учёных. Это было связано с тем, что элементы, содержащиеся в количестве ниже уровня чувствительности метода, при анализе не обнаруживались. Создавалась иллюзия их полного отсутствия.
В итоге усилий учёных разных стран в 20-х годах XX века сложилось общее представление о составе земной коры. Средние значения относительного содержания химических элементов в земной коре и других глобальных и космических системах известный геохимик А.Е. Ферсман предложил называть кларками в честь учёного, который наметил путь к количественной оценке распространения химических элементов.
Кларковое число (или кларки элементов) — число, выражающие среднее содержание химических элементов в земной коре, гидросфере, Земле, космических телах, геохимических или космохимических системах, по отношению к общей массе этой системы.
Кларк — весьма важная величина в геохимии. Анализ значений кларков позволяет понять многие закономерности распределения химических элементов на Земле, в Солнечной системе и доступной нашим наблюдениям части Вселенной.
Следует сказать, что есть разное понимание кларка в разных странах. В частности, Японии. В России кларк является синонимом «относительного содержания элементов» в любом объекте, как в весовом соотношении, так и в атомном (числе атомов) соотношении, и обозначение не ограничивается процентами.
В Японии этот термин имеет более узкое значение, чем у А.Е. Ферсмана. Могут применяться некоторые из следующих ограничений:
-
Применяется только для земной коры
-
Литосфера рассматривается ниже 10 миль от уровня моря
-
Должны быть включены все три слоя: литосфера (93,06 %), гидросфера (0,91 %) и атмосфера (0,03 %)
-
Рассматривается только соотношение масс
-
Обозначается только в процентах ( не в
ppmи не вppb)
ppm — миллионная доля. Единица измерения каких-либо относительных величин, равная 1 × 10−6 от базового показателя.
ppb — миллиардная доля. Единица измерения каких-либо относительных величин, равная 1 × 10−9 от базового показателя.
Кларки химических элементов земной коры различаются более чем на десять математических порядков. Столь существенное количественное различие должно отразиться на качественно неодинаковой роли групп элементов в земной коре. Наиболее ярко это проявляется в том, что элементы первой группы, содержащиеся в относительно большом количестве, образуют самостоятельные химические соединения, а элементы второй группы с малыми кларками преимущественно распылены, рассеяны среди химических соединений других элементов. Элементы первой группы называют главными, элементы второй — рассеянными. Условной границей между группами главных и рассеянных элементов в земной коре может служить величина 0,1 % (1000 ppm), хотя кларки большей части рассеянных элементов значительно меньше и измеряются тысячными и меньшими долями процента.
Наиболее объективными являются данные по распространенности химических элементов в отдельных средах. Данные для Земли в целом в значительной степени гипотетичны из-за отсутствия точных сведений о химическом составе глубинных геосфер, и приводимые различными авторами значения существенно разнятся в зависимости от теоретических воззрений автора. К тому же, состав глубинных геосфер на процессы в географической оболочке и, соответственно, биосфере существенного влияния не оказывает. Живое вещество распространено в пределах трёх геосфер: земной коры, атмосферы, гидросферы, а потому именно их химизм особенно важен.
Содержание химических элементов в геосферах Земли¶
Содержание химических элементов в земной коре¶
По относительному содержанию химических элементов ведущая роль, несомненно, принадлежит земной коре, так как её общая масса многократно превосходит суммарную массу гидросферы и атмосферы. Поэтому данные об относительном содержании того или иного химического элемента в земной коре можно в значительной мере считать и отражающими его содержание в биосфере в целом.
Наружная твердая оболочка Земли — земная кора более чем на 99 % (по весу) сложена всего 9 основными элементами:
O (47 %), Si (29,5 %), Al (8,05 %), Fe (4,65 %), Ca (2,96 %), Na (2,50 %), K (2,50 %), Mg (1,87 %), Ti (0,45 %). В сумме — 99,48 %. Из них кислород является абсолютно преобладающим. Наглядно видно, сколько остаётся на все остальные элементы.
Есть и другой вариант оценки — по объёму (объёмные проценты). Вычисляется с учётом размеров атомных и ионных радиусов в конкретных минеральных соединениях, образуемых этими элементами. Содержания в земной коре наиболее распространённых элементов в объёмных процентах составляют (по В.М. Гольдшмидту): O — 93,77 %, K — 2,14 %, Na — 1,60 %, Ca — 1,48 %, Si — 0,86 %, Al — 0,76 %, Fe — 0,68 %, Mg — 0,56 %, Ti — 0,22 %.
Очевидны достаточно существенные различия в распределении атомов химических элементов по весу и объему:
- в резком понижении относительного содержания Al и особенно Si (из-за малых размеров их атомов, а для кремния — в ещё большей мере ионов в его кислородных соединениях)
- ещё более явно подчеркивается ведущая роль кислорода в литосфере (оксисфера по В.М. Гольдшмидту).
В условиях Земли аномально низки содержания еще двух элементов: H и He. Это связано с их «летучестью». Оба эти элемента — газы, и, к тому же, самые легкие. Поэтому атомарные водород и гелий имеют тенденцию перемещаться в верхние слои атмосферы, а оттуда, не удерживаясь земным тяготением, рассеиваются в космическом пространстве. Водород до сих пор не потерян полностью, так как большая его часть входит в состав химических соединений — воды, гидрооксидов, гидрокарбонатов, гидросиликатов, органических соединений и других. А гелий, являющийся инертным газом, постоянно образуется как продукт радиоактивного распада тяжелых атомов.
Таким образом, земная кора по существу является упаковкой анионов кислорода, связанных друг с другом кремнием и ионами металлов, т.е. она состоит почти исключительно из кислородных соединений, преимущественно, из силикатов алюминия, кальция, магния, натрия, калия и железа.
Определение кларков для литосферы в целом является наиболее сложной задачей, так как её строение очень неоднородно. Наиболее точные значения распространенности элементов в земной коре удалось получить только после того, как стало возможным привлечь данные о строении океанического дна. О том, что на современном этапе получена картина, достаточно полно отражающая реальное распределение химических элементов в литосфере, свидетельствует хорошая сходимость подсчётов, производившихся в последние 20–30 лет учёными из разных стран, использовавшими разный набор исходных данных и различные методики осреднения. Противоречивыми остаются пока данные лишь по небольшому числу мало распространённых элементов, и уточнение их кларков ещё остаётся в числе задач будущих геохимических исследований.
В практике геохимических исследований точные значения кларков бывают нужны не всегда.
Порядок кларков различных элементов по В.Ф. Барабанову:
- Более 10 000 г/т — O, Si, Al, Fe, Ca, Mg, Na, K.
- 1000–10 000 г/т — Mn, Ti.
- 100–1000 г/т — C, F, P, S, Cl, Rb, Sr, Zr, Ba.
- 10–100 г/т — Pb, Th, Y, Nb, La, Ce, Nd, Li, B, N, Sc, V, Cr, Co, Ni, Cu, Zn, Ga.
- 1–10 г/т — Eu, Dy, Ho, Er, Yb, Hf, Ta, W, Tl, U, Ge, As, Br, Mo, Sn, Sc, Pm, Sm, Be.
- 0,1–1,0 г/т — Cd, Bi, In, Tu, I, Sb, Lu.
- 0,01–0,1 г/т — Ar, Se, Ag, Hg.
- 0,001–0,01 г/т — Re, Os, Ir, Ru, Rh, Pd, Te, Pt, He, Au.
По этой градации элементы, имеющие кларки выше 1000 г/т будут относиться к макроэлементам. Те, у которых кларки ниже — микроэлементы.
Анализируя, приведенные цифры, можно прийти к следующим выводам. Так, из вышеприведенных данных отчетливо видно, что некоторые элементы, которые уже давно известны и широко используются человечеством, являются очень редкими. В то же время, часть достаточно широко распространенных элементов практически не используется или используется пока очень слабо. Например, медь имеет значительно меньшую распространенность, чем цирконий; распространенность свинца сравнима с распространенностью галлия. Вместе с этим, относительно распространенными оказываются многие необычные на наш взгляд элементы. Так, рубидий находится в природе в количествах, сравнимых с никелем, ванадий — значительно более распространенный элемент, чем олово, скандий — чем мышьяк, а гафний более распространен в природе, чем йод!
Поэтому необходимо проводить четкое различие между распространенностью элемента и его «доступностью». Это связано с тем, что некоторые элементы, хотя и находятся в земной коре в заметных количествах, оказываются рассеянными в различных минералах, образованных другими элементами и никогда не встречаются в высоких концентрациях. Примерами могут быть рубидий, рассеянный в калиевых минералах и галлий в минералах алюминия. Другие элементы, например, титан и цирконий, хотя и образуют собственные минералы, воспринимаются нами как достаточно редкие. Дело в том, что минералы этих элементов обычно являются акцессорными, то есть рассеяны в горных породах в незначительных количествах. Многие же сравнительно редкие элементы, такие как золото, медь, серебро, платина, свинец, цинк и другие, известные с глубокой древности, не только образуют самостоятельные минералы, но и способны образовывать значительные скопления, то есть концентрироваться в ходе природных процессов, что делает их сравнительно легко доступными для добычи и последующего использования человеком.
Учёт кларков необходим для правильного понимания закономерностей процессов миграции химических элементов.
Содержание химических элементов в гидросфере¶
Природные воды представляют собой сложный раствор различных веществ. Значение химического состава воды в природе трудно переоценить. Без растворенных в воде солей и газов не было бы в водоемах растительности, водных животных. Состав воды определяет многие ее физические свойства и характер протекающих в ней процессов. Формирование химического состава вод происходит под влиянием двух независимых факторов:
- общих естественно-исторических и геологических условий,
- антропогенного воздействия.
Изменение химического состава вод, вызванное хозяйственной деятельностью человека, обусловлено внедрением в гидросферу огромного количества отходов сельскохозяйственного и промышленного производства и различного вида сточных вод, которые, попадая в реки, озера и грунтовые воды, вызывают их загрязнение.
Природные воды по химическому составу весьма разнообразны; они содержат в себе растворенные газы, соли, органические вещества. С некоторой условностью составляющие природных вод можно разделить на следующие пять групп:
-
Главные ионы, то есть ионы, содержащиеся в наибольшем количестве, это — хлоридные Cl–, сульфатные \(\ce{SO4^2–^}\) , гидрокарбонатные HCO–3, карбонатные \(\ce{CO3^2–^}\), натрия Na+, калия K+, магния Mg2+, кальция Ca2+.
-
Хлоридные ионы присутствуют почти во всех природных водах. Концентрация их изменяется примерно от 0,1 мг/л в арктических снегах до 150 мг/л в рассолах. Основными естественными источниками поступления хлоридов в природные воды являются:
- вынос из почв и водовмещающих пород;
- привнос хлоридов ветром и атмосферными осадками из океана;
- растворение солевой пыли, содержащейся в атмосфере.
Все хлориды хорошо растворимы, их осаждение из воды возможно лишь при замерзании и испарении. Они относительно слабо подвержены ионному обмену, адсорбции и воздействию биологических факторов. Таким образом, если в водном растворе оказался хлорид, естественные процессы с трудом выводят его из раствора.
-
Сульфатные ионы, так же как и хлоридные, распространены повсеместно в природных водах. Концентрация их колеблется в пределах 0,2–100 мг/л. Наименьшая концентрация сульфат-иона наблюдается в атмосферных осадках, а также в подземных и поверхностных водах, в которых сульфаты подвержены восстановлению.
Атмосферные осадки содержат сульфаты в среднем до 2 мг/л. Хотя абсолютная концентрация сульфат-иона в атмосферных осадках и невелика, они являются основным поставщиком сульфатов в поверхностные воды. Источниками сульфатов в атмосфере служат частицы пыли, содержащие сульфатные минералы, а также газы (двуокись серы и сероводород), которые, окисляясь, дают сульфаты.
-
Карбонатные и гидрокарбонатные ионы поступают в природные воды за счет углекислого газа атмосферы, двуокиси углерода почвы и растворения карбонатных пород. Преобладающими являются гидрокарбонатные ионы (в большинстве случаев pH природных вод близко к нейтральным). Подземные воды содержат от 10 до 800 мг/л гидрокарбонатных ионов, наиболее распространенные концентрации 50–400 мг/л.
-
Кальций-ион — один из наиболее распространенных катионов природных вод. Он поступает в воду в результате выщелачивания из пород и почв. Поверхностные воды при равновесии с атмосферным углекислым газом могут содержать 20–30 мг/л кальция при насыщении.
-
Магний-ион по своим геохимическим свойствам близок к кальцию. Растворимость карбоната магния также зависит от наличия двуокиси углерода. В условиях равновесия с углекислым газом атмосферы в природные воды поступает до 190 мг/л магния. В почвенных водах с повышенным содержанием двуокиси углерода количество растворенного магния значительно возрастает. Концентрация магния в воде обычно составляет от 1 до 40 мг/л.
-
Натрий и калий поступают в природные воды при выщелачивании горных пород и почв. Все природные воды содержат определенные количества этих ионов. Концентрации их в природных водах составляют: натрий-ион 1–20 мг/л, калий-ион до 10 мг/л. С увеличением общей минерализации содержание ионов натрия и калия, как правило, возрастает.
-
-
Растворенные газы — кислород O2, двуокись углерода CO2, сероводород H2S и другие.
Главные газы, составляющие атмосферу, — кислород, азот и углекислый газ — в известной мере растворимы в воде и являются необходимыми компонентами природных водных растворов. В поверхностных и неглубоких подземных водах содержание этих газов определяется взаимодействием с атмосферой, а также биохимическими процессами. Все газы и особенно кислород исключительно важны для поддержания жизни в гидросфере.
Кроме того, кислород и углекислый газ (последний, растворяясь в воде, образует углекислоту) играют большую роль при взаимодействии природных вод с горными породами. Содержание кислорода в воде определяется двумя группами противоположных процессов, одни из которых увеличивают концентрацию кислорода, а другие уменьшают. Обогащение вод кислородом происходит в результате их взаимодействия с атмосферой и путем выделения его из растений в процессе фотосинтеза. Поглощение кислорода связано с биохимическими процессами и процессами окисления. Соотношение между поступлением и поглощением кислорода определяет его концентрацию в воде, которая колеблется в пределах от 0 до 14,6 мг/л. Уменьшение содержания кислорода в воде, вызываемое накоплением в водах веществ, активно поглощающих кислород (например, разлагающихся органических продуктов), губительно сказывается на развитии жизни в гидросфере.
Углекислый газ растворим в воде в гораздо большей степени, чем кислород или азот. Его источниками в природных водах являются CO2, поступающий из атмосферы, и процессы окисления органических веществ. Между CO2 атмосферы и CO2, растворенным в воде, существует непрерывный обмен, направленный на установление равновесия. Обычно пресные воды, в которых протекают различные процессы разложения органических веществ, имеют повышенное содержание CO2 и поэтому выделяют углекислый газ в атмосферу. В связи с более высокой растворимостью углекислого газа в воде по сравнению с кислородом отношение кислорода к углекислому газу в атмосфере, приблизительно равное 700:1, в пресной воде при различных температурах колеблется от 15:1 при 0 °С до почти 20:1 при 30 °С. Для азота, растворимость составляющая при 0 °С 0,02 л на 1 л воды, при повышении температуры до 30 °С уменьшается в два раза.
-
Биогенные элементы — соединения азота, фосфора, кремния.
Азот присутствует в воде в виде как неорганических, так и разнообразных органических соединений. Неорганические соединения азота — аммоний NH4, нитриты \(\ce{NO2^–^}\) и нитраты \(\ce{NO3^–^}\). Органические соединения азота находятся в составе белка тканей организмов и продуктов его распада и присутствуют в воде при биологических процессах и биохимическом распаде остатков организмов.
Поступление неорганических соединений азота в воды происходит при биологическом распаде азотсодержащих соединений, а также вместе с атмосферными осадками. Концентрация неорганического азота в природных водах определяется интенсивностью процессов потребления соединений азота и скоростью процессов регенерации биогенных элементов. Средняя концентрация ионов аммония в естественных условиях не превышает 0,5 мг/л. Нитритные ионы (\(\ce{NO2^–^}\)) очень неустойчивы в поверхностных условиях, поэтому концентрация их в водах, как правило, не более тысячных долей миллиграмма на литр (в пересчете на азот). Наибольшая концентрация их отмечается осенью. Соединения фосфора присутствуют в природных водах в виде неорганических и органических соединений. Основным фактором, определяющим концентрацию фосфора, является обмен его между неорганическими и органическими формами, а также живыми организмами. Содержание фосфора в природных водах обычно не превышает десятых долей миллиграмма на литр.
-
Микроэлементы — все прочие химические элементы, присутствующие в природных водах в несравненно меньших количествах, чем главные ионы.
Целый ряд элементов, не включенных в описанные выше группы, имеет широкое распространение в природных водах, но концентрации их очень малы и, как правило, не превышают тысячных долей миллиграмма на литр. Такими элементами являются тяжелые металлы (Zn, Си, Pb, Ni, Со и другие), редкие металлы (Li, Rb, Cs, Be и так далее), галогены (Br, I, F), радиоактивные элементы и другие. Несмотря на низкие концентрации, распространение микроэлементов в водах представляет большой интерес. Состав микроэлементов указывает на геологическую историю воды. Кроме того, аномально высокие содержания ряда металлов в природных водах служат индикаторами при поисках рудных месторождений. Многие из этих компонентов даже в ничтожных концентрациях влияют на жизнедеятельность растений и животных.
-
Органические вещества.
Для количественной характеристики органического вещества используют косвенные показатели, такие как содержание углерода, окисляемость и биохимическое потребление кислорода. Органические вещества в естественных условиях поступают в природные воды из почв, торфяников, лесного перегноя и других видов природных образований, а также образуются в самом водоеме. Общая концентрация органических веществ в природных водах колеблется в широких пределах. Наибольшее содержание их (до 50 мг/л) отмечается в болотных водах и реках с болотным питанием.
Среднее содержание органики в реках обычно не превышает 20 мг/л. Вывод органических веществ из воды осуществляется в результате химических и биохимических процессов, а также адсорбции взвесями. Органические вещества, растворенные в воде, связывают многие микроэлементы в хорошо растворимые комплексы, чем значительно увеличивают их миграционную способность.
Несмотря на то, что общее количество наземных вод незначительно по сравнению с общей массой гидросферы, геохимически они очень важны, поскольку принимают активное участие в большинстве процессов, протекающих в биосфере. Для понимания этих и других процессов, происходящих в зоне гипергенеза, необходимо знать состав этих вод, то есть их основные химические параметры. В первую очередь, это минерализация, ионный состав и окислительно-восстановительные условия вод.
Минерализация отражает общее количество растворённых минеральных веществ. А.И. Перельман выделяют следующие семейства:
- Ультрапресные воды (< 0,1 г/л). Большая часть атмосферных осадков, поверхностные и грунтовые воды тундровых, высокогорных ландшафтов. Обладают повышенной растворяющей способностью.
- Пресные воды (0,1–1 г/л). Характерны для большинства рек, озёр и грунтовых вод во влажном климате.
- Солоноватые воды (1–3 г/л). развиты в степях, саваннах, пустынях. Растворяющая способность ослаблена, из них при небольшом повышении концентрации осаждаются труднорастворимые соли, что вызывает карбонатизацию и огипсование почв.
- Солёные воды (3–36 г/л). Океаны, слабо солёные озёра, часть грунтовых вод.
- Рассолы (> 36 г/л). Солёные озёра и грунтовые воды наиболее засушливых ландшафтов. Осаждение широкого химического набора солей.
Ионный состав вод. Ведущее значение для классификации имеют только ионы элементов с высокими кларками (O, Ca, Mg, Na, K, S, Cl и другие). Наиболее распространены в ландшафтах три катиона (Ca2+, Mg2+, Na+^) и три аниона (\(\ce{HCO3^–^}\), \(\ce{SO4^2–^}\), Cl). Иногда ведущее значение приобретают CO3–, HS–, \(\ce{S2^–^}\). Также велико значение содержаний ионов H+ и ОН, но это уже касается выделения классов вод по кислотности-щёлочности.
Ионный состав вод определяет их многие геохимические свойства, а также возможности использования в хозяйственной деятельности.
Виды вод по анионному составу:
- гидрокарбонатные;
- сульфатные;
- хлоридные.
Дальнейшее подразделение природных вод производится по катионному составу и соотношениям ионов.
Щелочно-кислотные условия вод. Характеризуются величиной pH. От изменения этого параметра существенно зависит растворимость различных соединений. Так, осаждение из растворов гидроксидов металлов зависит, главным образом, от соотношения двух параметров: величины pH и концентрации ионов металлов в растворе.
Классы вод по щелочности-кислотности:
- Сильнокислые (pH < 3–4). Распространены, как правило, на небольших площадях. Возникновение обычно связано с окислением сульфидов, проявлениями вулканической деятельности. Широко распространены в техногенных ландшафтах.
- Слабокислые (рН от 3–4 до 6,5). Кислотность обусловлена разложением органических веществ. Широко распространены в гумидных ландшафтах.
- Нейтральные и слабощелочные (рН от 6,5 до 8,5). Характерны для аридных ландшафтов, в условиях более высокой концентрации карбонатных ионов.
- Сильнощелочные (рН > 8,5) — содовые воды. Высокая щёлочность обусловлена присутствием NaHCO3.
Органические соединения обладают способностью усреднять сильнокислую и сильнощелочную среду. Слабые органические кислоты нейтрализуют щёлочи и делают щелочную реакцию более слабой, а слабые органические основания таким же образом нейтрализуют сильные кислоты.
Окислительно-восстановительные условия вод. Окисление — отдача электронов, восстановление — их присоединение.
Важнейший окислитель в ландшафтных средах — кислород, что обусловлено его высоким кларком и химической активностью. Важные окислители — \(\ce{SO4^2-^}\), CO2, NO3, Fe3+ и другие. Важнейшие восстановители — H2, H2S, CH4 и другие органические соединения, Fe2+ и другие. Один и тот же элемент, в зависимости от ионной формы его нахождения, может быть либо окислителем, либо восстановителем (Fe, Mn).
Классы вод по окислительно-восстановительным условиям:
- Кислородные воды. Характерно присутствие свободного кислорода, поступающего из воздуха или за счёт фотосинтеза водных растений. Воды с высокой окислительной способностью, в них действуют аэробные бактерии, окисляющие органические вещества.
- Глеевые воды. Восстановительные без сероводорода. Формируются там, где мало свободного кислорода и много органических остатков. Органические вещества окисляются анаэробными бактериями за счёт кислорода неорганических соединений.
- Сероводородные воды. Содержат HS, HS. Возникают в бескислородных условиях при высоких содержаниях SO, где анаэробные бактерии окисляют органические вещества за счёт восстановления сульфатов. Характерны для солончаков, илов солёных озёр, глубоких подземных вод в некоторых районах, для побережий, подпитываемых морскими водами (мангры).
Содержание химических элементов в атмосфере¶
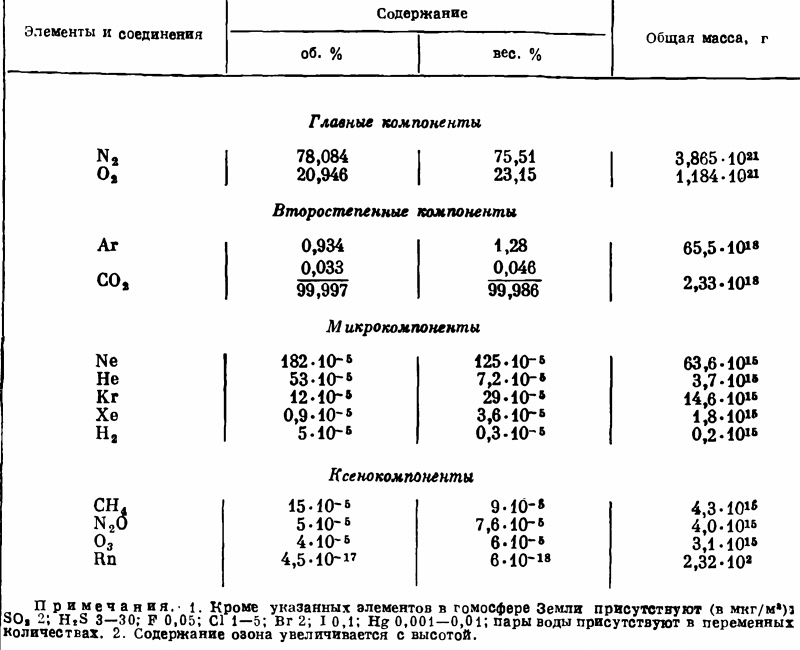
Химический состав атмосферы определяется присутствием четырех главных компонентов, составляющих более 99,99 % ее массы — азота, кислорода, аргона и углекислого газа. Другие элементы присутствуют в атмосфере в незначительных количествах.
Кроме того, постоянными газовыми составляющими атмосферы является также ряд микрокомпонентов, представленных главным образом редкими инертными газами (неон, гелий, криптон и ксенон) и водородом.
Кроме постоянных составных частей в атмосфере обычно присутствуют в переменных количествах ксенокомпоненты, являющиеся временными примесями, поступление которых обязано вулканической деятельности, жизнедеятельности биосферы, а также производственной и бытовой деятельности человека (метан, закись азота, озон и радон). Большая часть ксенокомпонентов атмосферы в повышенных концентрациях оказывает отрицательное влияние на развитие растительности и живых организмов и, таким образом, должна рассматриваться как загрязнитель окружающей среды.
Конвекционные потоки поддерживают постоянство относительного содержания компонентов вплоть до высоты 60 км, но выше может происходить гравитационное разделение по молекулярным массам, однако даже на больших высотах преобладают кислород и азот. По мере удаления от поверхности Земли атмосфера становится все более и более разреженной, постепенно переходя в межпланетное пространство. С точки зрения химического состава атмосферу можно рассматривать как однородную оболочку, плотность которой монотонно убывает с высотой, но в ней выделяются структурные зоны, существенно различающиеся по физическим свойствам.
Разные авторы оценивают массу атмосферы около 50 × 1020 г. Последние наиболее тщательные расчеты дают значение 51,17 × 1020 г для массы сухой атмосферы, то есть без учета водяных паров.